Реакции 2-ариламинометилимидазолинов с оксалилхлоридом и метилбромацетатом
Магеррамов
Абель Мамедали оглы,
академик НАН Азербайджанской Республики,
ректор Бакинского государственного университета,
Аллахвердиев
Мирза Алекбер оглы,
профессор кафедры органической химии
Бакинского государственного университета, руководитель лаборатории Института
химии присадок НАН Азербайджанской Республики,
Аллахяров
Эльбрус Камал оглы,
соискатель Института химии присадок НАН
Азербайджанской Республики.
Как известно, производные имидазолины являются лекарственными преператами.
Например, глазолин, нафтизин, фентоламин и др. Они также являются фунгицидами,
ускорителями вулканизации, катионными ПАВ для масло- и грязеотталкивающей обработки тканей и волокон.
Учитывая вышеизложенное,
представляет интерес попытаться вовлечь 2-ариламинометилимидазолины (1) в
реакции с бис-электрофилами так, чтобы два нуклеофильных центра имидазолина (1) взаимодействовали с электрофильными
центрами одной молекулы бис-электрофила с формированием нового циклического
фрагмента.
Для построения конденсированных трициклических систем ранее активно использовались реакции
2-аминоалкилбензимидазолов с одно- и двухатомными электрофилами [2, 3, 7]. Ациклические
амидины α- и β-
аминокислот применялись в качестве 1,4- и 1,5-бинуклеофилов в синтезе 5-7-членных
азотосодержащих гетероциклов [4-6].
Оказалось, что
2-ариламинометилимидазолины (1) уже при -300С в присутствии избытка Et3N
гладко реагирует с оксалилхлоридом
с образованием гексагидро-5,6-диоксоимидазо [1, 2-e] пиразинов (2).
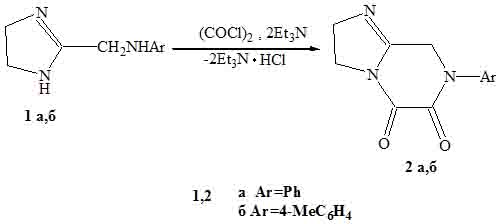
Так как, атомы азота
имидазолинового цикла значительно нуклеофильны, чем атом азота ариламиногруппы,
по-видимому, первоначально происходит ацилирование по
азоту цикла с образованием интермедиатов монохлорангидридного характера,
которые далее циклизуются в присутствии основания в конечные продукты (2).
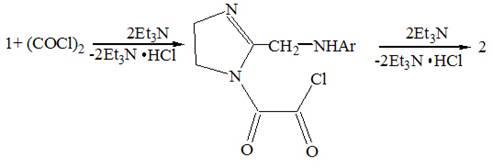
В ИК-спектрах
соединений (2) имеются по две интенсивных полос поглощения νС=O
1710 и 1665 см-1 и
мене интенсивная полоса поглощения 1645 см-1, которую можно отнести
к νС=N связи. Вместе с тем, неожиданно в ИК-спектрах
(2) присутствует заметно различимая полоса поглощения в области 3300-3350 см-1,
которая может быть обусловлена наличием высоко-ассоциированной N-H связей. Это может быть связано с тем, что нами
полученные бициклы (2)
находятся в таутомерном равновесии с 2-енимида-золидиновыми таутомерами
(3), в структурах которых присутствует N-H связь.
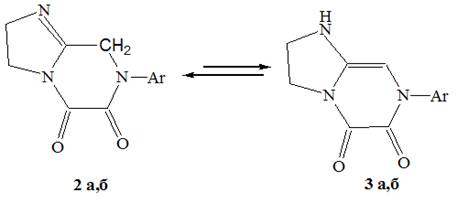
Косвенно в пользу этого
предположения свидетельствует и характер ПМР-спектров полученных соединений:
как при съемке на частоте 60 МГц, так и при съемке на 250 Мгц в спектрах соединений
(2) не наблюдается ни узкого синглета протонов α-метиленовой
(по отношению к С2–атому имидазолинового
цикла) группы, ни двух четких отдельных сигналов, которые должны были бы
зафиксироваться в том случае, если бы эти протоны оказались неэквивалентными.
Вместе этого наблюдается уширенный мультиплет-ный сигнал в характерной для α-метиленовой группы области
4.05-![]() со скоростью
взаимопревращения таутомеров, соизмеримой со временем релаксации метиленовых и
винильных протонов при С8 в шестичленных циклах 2 и 3.
со скоростью
взаимопревращения таутомеров, соизмеримой со временем релаксации метиленовых и
винильных протонов при С8 в шестичленных циклах 2 и 3.
Брутто-структура (2б) надежно
подтверждается данными масс-спектра электронного удара:
243
[M] + (42), 215 [M−CO] + (15), 187 [M−2CO] + (2),
186
[M−2CO−H] +, 133 [ArNCO] + (13), 120 [ArNH=CH2] + (26),
119
[ArN=CH2] + (100), 106 [ArNH] + (78), 91 [Ar]
+ (34),
57 [CH2=N=C=O]+
(7)
Как видно из приведенных данных, в
масс-спектре (2б) присутствуют пики арилкатиона и
ариламинокатиона, причем последний явно образуется за счет миграции водорода с CH2-группы на атом азота. Весьма характерным направлением фрагментации
молекулярного иона обсуждаемой структуры является выброс ион-радикала
изоцианата [ArNCO]+.
Альтернативный и наиболее распространенный путь распада [M]+- выброс ион-радикала N-арилметиленимина [ArN=CH2] + (90-100%).
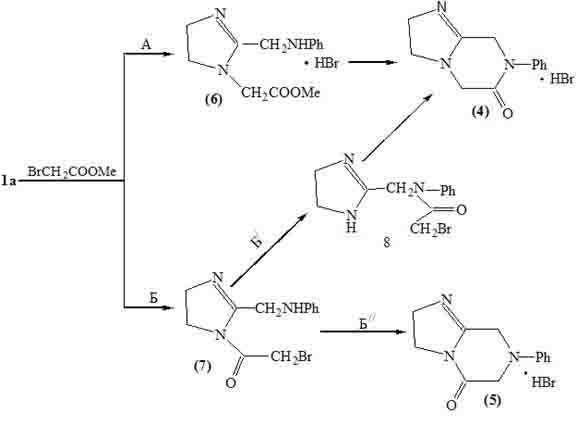
Интересно было использовать для
циклизации 2-ариламинометилими-дазолинов (1) бис-электрофилы
несимметричного строения. Простейшими представителями такого рода
бис-электрофилов являются эфиры 2-галоид-карбоновых кислот, имеющие электрофильные центры как ацилирующего, так и алкилирующего
характера.
Как и следовало ожидать,
взаимодействие (1а) с таким несимметричным бис-электрофилом
как метилбромацетат, протекает более сложно, чем реакция с
симметричным дихлорангидридом−оксалилхлоридом.
 С
небольшим выходом выделен продукт, соответствующий по составу бициклам (4) и
(5). На основании анализа характера фрагментации в масс-спектре электронного удара
ему была приписана структура (4). Изомерная структура (5) исключается,
поскольку при его диссоциативной ионизации не может образоваться ион с m/z 119 состава [Ph-N=C=O]+,
который наблюдает-ся в
масс-спектре полученного соединения:
С
небольшим выходом выделен продукт, соответствующий по составу бициклам (4) и
(5). На основании анализа характера фрагментации в масс-спектре электронного удара
ему была приписана структура (4). Изомерная структура (5) исключается,
поскольку при его диссоциативной ионизации не может образоваться ион с m/z 119 состава [Ph-N=C=O]+,
который наблюдает-ся в
масс-спектре полученного соединения:
215 [M] + (62), 187 [M-CO] + (13),
186 [M-C2H4-H] + (14), 119 [ArNCO] +
(4),
106 [ArNH=CH2]
+ (13), 105 [ArN=CH2] +
(100), 104 [ArN=C=O] + (16),
96 [M-ArNCO] + (15), 77 [Ar] (23), 56 [CH2N=C=O] (30).
В масс-спектре полученного
продукта (4) кроме интенсивного иона [M+-HBr] c m/z 215 присутствуют также
практически все основные осколочные ионы, ожидаемые для диссоциативной
ионизации этого соединения.
В ИК-спектре
(4) присутствует слабое поглощение в области 2400-2800 см-1, обусловленное
νNH+. Положение полосы поглощения νС=N 1610 см-1 характерно для N1-неацилированных имидазолинов [1].
В ПМР-спектре
соли (4) в отличие от спектров соединений (2) наблюдаются достаточно узкие синглеты
имидазолинового цикла, а также попарно эквивалентных геминальных протонов при C5 и C8 бициклической системы, что связано с
отсутствием заметных таутомерных превращений в этой структуре.
Исходя из
строения конечного продукта (4), первой стадией его образования, вероятно, является
алкилирование имидазолина (1а) метилбромацетатом
с образованием интермедиата (6), в котором далее протекает внутри-молекулярная
реакция аминолиза сложного эфира с вытеснением спирта
и циклизацией, то есть реализуется направление А. Потенциально конечный продукт
мог бы образоваться путем внутримолекулярного алкилирования
имидазолинового фрагмента в интермедиате (8) (направление
Б-Б/). Однако
эта последовательность стадий представляется весьма маловероятной. Вместе с
тем, мы не можем категорически отвергнуть и возможность первоначального ацилирования метилбромацетатом имидазолинового цикла с образованием интермедиата
(7), однако ни этот полупродукт, ни ожидаемый продукт его циклизации (5)
(направление Б-Б//) выделены не были.
Ниже приведена таблица отражающая
результаты проведенных нами физико-химического и элементного анализа соединений
2 (а, б) и 4.
Таблица
1.
Выходы
и некоторые физико-химические константы синтези-рованных
соединений 2(а, б) и 4.
|
№
соед. |
Выход, % |
Т.пл., 0С |
ИК-спектр,
ν, см-1 |
ЯМР
1H
спектр, δ, м.д. |
|
2а |
70,1 |
226-228 |
1647 (C=N), 1710,
1665 (C=O) |
3.15-
6.82- ((CD3)2SO.). |
|
2б |
70,5 |
213-215 |
1645 (C=N), 1710, 1665 (C=O) |
3.07-3.97м. (4H, CH2-CH2),
7.12 с.м. (4Н, С6Н4),
((CD3)2SO.). |
|
4 |
27,0 |
312-316 |
1610
(C=N), 1665(C=O) |
4.17 с.(4H, CH2-CH2),
7.37 с.м. (5Н, Ph). ((CF3COOD.) |
|
№
соед. |
Найдено/Вычислено,
% |
Брутто-
формула |
|||
|
C |
H |
Hlg |
N |
||
|
2а |
|
|
---- |
|
C12H11N3O2 |
|
2б |
|
|
---- |
|
C13H13N3O2 |
|
4 |
|
|
|
|
C12H14N3OBr |
Экспериментальная
часть
ИК спектры синтезированных
соединений записывались на спектрометре «Specord-75 IR» в виде тонких пленок в вазелиновом масле в
таблетках с KBr. Спектры ЯМР 1H записывались на спектрометре «Bruker 300».
Масс-спектры электронного удара и химической
ионизации записывались на хроматомасс-спетрометре Hitachi M 90B,
оборудованной системой прямого ввода с энергией ионизирующих электронов 70 эВ,
эмиссией катода 100 МКА, температурой ионизационной коробки 140 0С.
7-Арил-2,3,5,6,7,8-гексагидро-5,6-диоксоимидазо [1,2-a] пиразины (2) (Общая методика).
К раствору 0,01М оксалилхлорида в
25 мл ТГФ при -20÷30 0С прибавляли раствор
Гидробромид 7-фенил-2,3,5,6,7,8-гексагидро-6-оксоимидазо [1,2-a] пиразина (4).
Смесь
Резюме
В работе были изучены ракции
2-ариламинометилимидазолинов, обладающие двумя нуклеофильными центрами, с электрофильными
реагентами оксалилхлорид и метилбромацетат.
1. Установлено, что 2-ариламинометилимидазолины
реагируют с окса-лилхлоридом с образованием
гексагидро-5,6-диоксоимидазо [1,2-e]
пиразинов.
2. Реакция
2-ариламинометилимидазолина с метилбромацетатом приводит к образованию гидробромид
7-фенил-2,3,5,6,7,8-гексагидро 6-оксо-имидазо [1,2-a] пиразина.
Строения полученных продуктов
были подтверждены методами физико-химического анализа.
Литература
1. П.А.Петров, В.В.Круть, Г.А.Тембер, Н.Т.Герасимова. Инфракрасные спектры
∆2-имидазолинов и их гидрохлоридов.// Журнал приключения
спектроскопии.-1979-Т.30.-С.850-857.
2.
B.S. Reddy, R.B. Reddy, G.V.P.C.Mouli, J.D.Reddy. Synthesis of new 1-aryl-2n-benzimidazolo- [2,1-e] imidazoles.// J. Indian
Chem. Soc.-1988.-Vol.65.-5,853-854.
3.
Benzimidazoles and congeneric
tricyclic compounds. Part 2.
// Ed. Preston P.H., N.-Y. : Interescience.-1980.
4. Keir W.F., Maclennan A.N., Wood H.C.B. Ethyl amidinoacetates
in the synthesis pyrazines.// J.Chem.Soc.Perkin
Trans.Part 2-1978.-№9.-P.1002-1006.
5.
Mendelberg M., Uber
2-aminosaure-amidine. //Chem.Ber.-1960.-B.93-№10-s.2230-2238.].
6.
Shaw.E. Wooley D.W. A new and conwenient synthesis of
4-amino-5-imidazol-conboxamide.// J.Biol.Chem.-1949.-Vol.181.-№1.-P.89-93.
7.
Whitney J.G., Antiinlammatory and / or analgenic imidazoimidazoles: US
Pat, № 447845. (C.A., 1985, Vol.102, 78883).
Поступила
в редакцию 05.08.2009 г.