Субстратная специфичность дрожжевой эстеразы в реакциях эфирообразования
Мирзарахметова Дилбар Тохтамуратовна,
кандидат технических наук, доцент кафедры микробиологии и биотехнологии Национального университета Узбекистана,
Райдер Елена Юрьевна,
соискатель биолого-почвенного факультета Национального университета Узбекистана.
Согласно современным представлениям о субстратной специфичности ферментов принято разграничивать специфичность к химической природе субстрата, специфичность к катализируемой реакции и специфичность к среде. Часто специфичность к среде в реакциях эфирообразования наблюдается в водно-органических средах при удачном подборе нужного органического растворителя и содержании воды. Она исследована недостаточно, т.к. изучению этих функций ферментов не уделялось достаточного внимания ввиду неясности их роли в биохимических процессах. Подобное явление изучено пока недостаточно, лишь на примере ряда гидролаз: липазы [Брокерхоф и др., 1978], фосфолипазы D [Рахимов и др., 1977; Марьяновкая и др.1989], протеазы [Рахимов и др., 1983] и инвертазы [Мирзарахметова и др., 2000]. Подобная активность присуща и эстеразе, которая, например, проявляется в естественных условиях: в бродящей среде в условиях лимитации роста дрожжей. При этом, спирты превращаются в эфиры [Авакянц, 1968; Абдуразакова, 1990].
В присутствии малых концентраций органической фазы большинство гидролаз не проявляют своей синтетазной активности, т.к. равновесие смещено в сторону гидролитической реакции. В биохимическом плане, такое поведение ферментов изучено недостаточно. По этой причине, целью настоящей работы являлось получение сведений о поведении нативной эстеразы Saccharomyces vini в водно-органических средах и изучение субстратной специфичности фермента в реакциях эфирообразования.
В работе была использована очищенная эстераза Saccharomyces vini. Cинтетазную активность эстеразы в водно-органической среде определяли по методу [Fukuda at al, 1998]. Количественный анализ белка в смеси проводили по методу [Lowry at al, 1954]. В качестве фазы растворителя был выбран ацетонитрил [Райдер и др, 2010]. Активность фермента выражают в условных единицах (у.е.). Условная единица синтезирующей эстеразы представляет собой такое количество фермента в 1л среды, которое катализирует синтез эфира из 1 микромоля уксусной кислоты за 1 мин при оптимальных условиях.
Субстратную специфичность эстеразы в реакциях эфирообразования можно рассмотреть, взяв в основу особенности строения молекул кислот и спиртов. В качестве их можно назвать следующее: длина углеводородной части кислоты, число остатков и их стерическое расположение, природа спиртовой части молекул, физическое состояние молекул (растворимое состояние) [Брокерхоф и др., 1978; Рахимов и др., 1977; Марьяновкая и др., 1989].
Специфичность фермента к длине спиртовых субстратов была изучена на основе уксусной кислоты и спиртов с углеродными цепями С2-С5. При переходе к более длинным углеводородным цепям наблюдалось увеличение скорости эфирообразования в ряду С3-С5. Результаты проведенных исследований показали (Рис.1), что фермент в среде с уксусной кислотой (0,5М) более активно действует на спирты, имеющие 5 углеродных атома в спиртовой молекуле – изоамиловый (300 Ед) и амиловый спирты (240 Ед), причем фермент проявлял активность в среде, содержащей 0,5М спиртов. С повышением концентрации спиртовых субстратов в среде наблюдается ингибирование фермента.
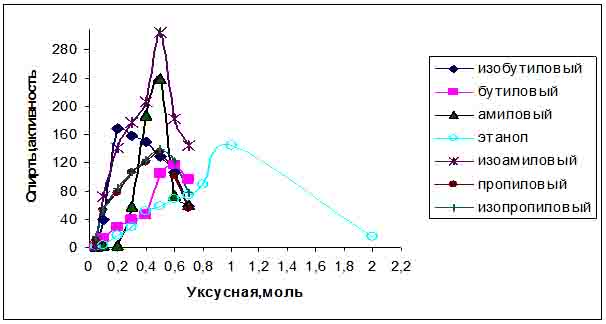
Рис. 1. Субстратная специфичность эстеразы в среде с уксусной кислотой и некоторыми спиртами.
Следует отметить, что фермент также проявляет свою активность со спиртами вторичный углеродный атом которых находится на одну - изобутиловым (170 Ед) и бутиловым спиртами (120 Ед) – при их концентрации в среде - 0,5М; на две - изопропиловым и пропиловым (130 Ед) спиртами - углеродные цепочки ближе к ОН-группе. С этанолом, по сравнению, с изоамиловым спиртом активность намного ниже (140 Ед) и специфичность ниже – 0,4М. Как видно из рисунка, активность эстеразы по отношению к изоамиловому спирту составляет 300 Ед, что превышает активность по отношению к н-амиловому в 1,25 раз, изобутиловому спирту в 1,76 раз, этиловому спирту-2,14, бутиловому спирту в 2,5 раза, и наконец к н-пропиловому и изопропиловому – 2,3 раза.
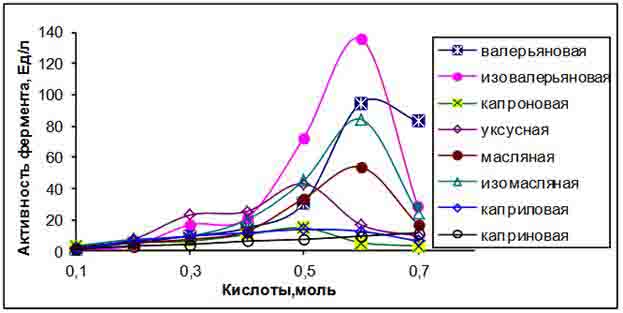
Рис. 2. Субстратная специфичность эстеразы в среде с этанолом и некоторыми кислотами.
Проведенные исследования позволили также впервые выявить определенную закономерность по отношению к субстратам с ограниченной растворимостью: с уменьшением растворимости спиртов в воде удельная активность фермента увеличивается. Поэтому, нами сделано предположение, что критерием “узнавания” субстрата является пространственное расположение ОН-групп у первого углеродного атома и разветвленность углеродной цепочки, а также удаленность вторичных углеродных атомов от гидроксильной группы спирта.
Вторым этапом работы было изучение специфичности фермента к различным кислотам. В качестве спиртового субстрата был выбран этанол. Эксперименты по изучению взаимодействия эстеразы с этиловым спиртом и исследуемыми летучими кислотами с углеродными цепями С1-С9 (уксусная, валерьяновая, изовалерьяновая, масляная, изоамсляная, капроновая, каприловая, каприновая) показали (рис. 2) увеличение эфирообразования в ряду от С1 к С4, с последующим уменьшением к С9. Кислоты с длиной углеводородной цепи С4 связывались быстрее.
В целом, на основании полученных данных можно считать, что дрожжевая эстераза обладает определенной специфичностью к жирной кислоте с четырьмя углеводородными атомами. Важное значение при этом имеет разветвленность углеродной цепочки. Как видно из рис. 2. эстераза проявляет большую активность с изо-формами кислот.
Таким образом, эстераза, обладая широкой субстратной специфичностью, преимущественно активна с С5-спиртами. Критерием «узнавания» субстрата является стерическое расположение спиртовой группы у четвертого углеродного атома, разветвлённость углеродной цепочки, дальность вторичных углеродных атомов от гидроксильной группы спирта. Кроме того, важна гидрофобность (растворимость) спиртового субстрата и длина углеводородной цепи кислотного субстрата. Аналогичные выводы были получены и с другими гидролазами, как например с ацилазой, липазой, протеазой и фосфолипазой [Рахимов, 1997].
Литература
1. Абдуразакова С.Х. Совершенствование технологии бродильных производств на основе стимулирования биокаталических процессов // -Ташкент: Фан, 1990. - 140 с.
2. Брокерхоф Х., Р.Дженсон Липолитические ферменты.// Москва: Мир. -1978. -396 с.
3. Марьяновкая И.Г., Сагатова Ф.А., Рахимов А.Х., Рахимов М.М.. Анализ ментоловых эфиров жирных кислот в присутствии ментола // Химия природных соединений. -1989. -№6, -С.855-856.
4. Мирзарахметова Д.Т., Абдуразакова С.Х., Ахмедова З.Р., Буриханов Ш.С. Субстратная специфичность инвертазы // Химия природных соединений. 2000. - №1. –С.14-17.
5. Райдер Е., Мирзарахметова Д. Дрожжевая эстераза в водно-органической среде // Узбекский биологический журнал. -2010. -№2. –С.9-11.
6. Рахимов М.М., Мадьяров Ш.Р. Иммобилизованная фосфолипаза Д // Биохимия. -1977. -Том 42. -№5. - С.622-633.
7. Рахимов М.М., Хасанов Х.Т. Стабилизация кислой протеиназы в системах с твердыми фазами // Прикладная биохимия и микробиология. -1983. -Том 21. -№5. - С.354-360.
8. Рахимов М.М., Кадирова З.Х., Абдурахимов А.А., Давранов К.Д. Ферментативный синтез глицеридов // Узбекский Биологический журнал. -1983. -№1. -С.4-6.
9. Fukuda, K., N.Yamamoto, Y.Kiyokawa, T.Yanagiuchi, Y.Wakai, K.Kitamoto, Y.Inoue, A.Kimura. Balance of activities of alcohol acetyltransferase and esterase in Saccharomyces cerevisiae is important for production of isoamyl acetat. // Appl. Environ. Microbiol. -1998. –Vol 64; -№10. - P.4076-4078.
10. Lowry, O., N.Rosenbryl, A.Farr. Protein measurement with the folin phenol reagent // J. Biol. Chem. -1954. -Vol 193. - P.265-275.
Поступила в редакцию 26.05.2011 г.