Изучение кинетики выщелачивания концентрата данбурита минеральными кислотами
Мирсаидов Ульмас Мирсаидович,
доктор химических наук, профессор, научный руководитель,
Маматов Эргаш Джумаевич,
кандидат технических наук, докторант,
Ашуров Наимджон Амонкулович,
кандидат технических наук.
Институт химии им. В.И.Никитина АН Республики Таджикистан.
| Линк ГДЗ по русскому языку 6 класс Ладыженская линк www.euroki.org |
Представлены результаты изучение кинетики выщелачивания данбуритового концентрата минеральными кислотами.
Оформление визы в Японию выгодные цены! Получите консультацию kolumbspb.su падук дерево woodmart.org
Проблема переработки производственных отходов, в том числе выбросов, является одной из актуальных задач промышленности. На производственном предприятии АООТ «Таджикхимпром» при электролизе поваренной соли попутно выделяется абгазная соляная кислота, а для сушки газообразного хлора применяют серную кислоту. Отработанная серная и попутно получаемая соляная кислота низкой концентрации в дальнейшем не находят применения, их нейтрализуют известняком и выбрасывают в шламонакопители. В последнее время отмечается тенденция использования отходов производства взамен более дорогостоящих материалов в технологических процессах [1-4]. В процессе выщелачивания концентрата данбурита используемые минеральные кислоты являются отходом данного производства. В этом плане представляло интерес исследование процесса выщелачивания концентрата данбурита.
Кинетику выщелачивания
концентрата данбурита проводили в термостатированном реакторе с мешалкой при
соотношении Т:Ж =1:10 при концентрации минеральных кислот: 20%-![]() , 45%-
, 45%-![]() и 15%-
и 15%-![]() соответственно. Затем
пульпу фильтровали, промывали водой и в растворе определяли содержание бора по
методике [5].
соответственно. Затем
пульпу фильтровали, промывали водой и в растворе определяли содержание бора по
методике [5].
Результаты экспериментальных данных кинетики извлечения оксида бора из обожженного данбуритового концентрата для серно-, азотно- и солянокислотного выщелачивания приведены на рис. 1 и 2.
В первом приближении кинетические кривые выщелачивания концентрата данбурита минеральными кислотами удовлетворительно описываются уравнением:
dα /dτ = K (1-α),
где: α- степень извлечения оксида бора; τ - время (мин); К - константа скорости реакции разложения концентрата данбурита для каждого процесса выщелачивания, мин-1 [6].
Между энергией активации (Е), температурой (Т) и константой скорости реакции (К) существует зависимость, выражаемая уравнением Аррениуса:
К
= Ко· е-Е/RT = ![]() или ln K = ln Ko -
или ln K = ln Ko - ![]() ,
,
где: е - основание натуральных логарифмов, Ко- предэкспоненциальный коэффициент, R – универсальная газовая постоянная, КДж/моль, град; Т – абсолютная температура, °К.
Для различных интервалов температуры были рассчитаны значения констант скорости (К) и найдены их средние значения (Кср).
Зависимость
кинетических кривых сернокислотного разложения данбурита показывает, что высокий
выход продукта, прямо пропорционален концентрации серной кислоты, температуры и,
до определенного предела концентрации [![]() =80-100%, от стехиометрического
количества и температуры – 900С]. Дальнейшее увеличение концентрации
кислоты и температуры привело к снижению степени извлечения оксида бора (рис. 1.).
=80-100%, от стехиометрического
количества и температуры – 900С]. Дальнейшее увеличение концентрации
кислоты и температуры привело к снижению степени извлечения оксида бора (рис. 1.).
Экспериментальные данные кинетики извлечения оксида бора из состава концентрата данбурита при сернокислотном разложении получены в интервале температур 20-900С и продолжительности процесса от 15 до 90 мин (рис. 1.а.).
Из характера кинетических кривых разложения концентрата данбурита серной кислотой видно, что целесообразно проводить процесс в течение 90 мин и температуре 900С, где переход оксида бора в раствор составляет 83.9%.
При построении графика зависимости lg1/(1-α) от времени все экспериментальные точки при различных температурах и процессах выщелачивания удовлетворительно укладываются на прямую линию и имеют отрицательный наклон.
Данные кинетики извлечения оксида бора из состава обожженного данбуритового концентрата при азотнокислотном разложении получены в интервале температур 20-95ºС и продолжительности процесса от 15 до 60 мин (рис. 1.б.).
Характер кинетических кривых разложения указывает на то, что в течение 60 мин при температуре 95ºС достигается 92.9%-ное извлечение оксида бора.
Кинетические кривые свидетельствуют о том, что при повышении температуры извлечение оксида бора из состава обожженного концентрата данбурита значительно возрастает.
Экспериментальные данные зависимости извлечения оксида бора для солянокислотного разложения, изучены при температурах 20-800С и продолжительности процесса от 15 до 60 мин (рис. 1.в.). Как видно, с повышением температуры извлечение оксида бора из состава концентрата данбурита постепенно увеличивается от 24.1 до 86.8%.
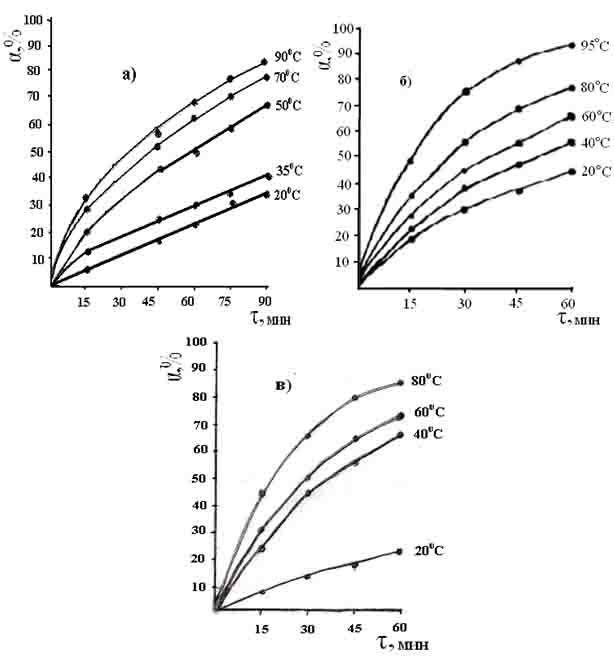
Рис. 1. Кинетические кривые выщелачивания концентрата данбурита серной (а), азотной (б), и соляной (в) кислотами.
Для выявления механизма реакции взаимодействия концентрата данбурита с минеральными кислотами была предпринята попытка определения лимитирующей стадии скорости процесса выщелачивания. Процесс взаимодействия зёрен (частиц) концентрата данбурита с раствором минеральных кислот, можно разделить на несколько последовательных стадий, основными из которых являются:
- перенос ионов водорода через слой пленки окружающей зерна концентрата данбурита к его поверхности (фазовая или внешняя диффузия);
- перенос ионов водорода внутри зерен концентрата к точке обмена фиксированных ионов (внутренняя диффузия);
- взаимодействие ионов водорода с зернами концентрата данбурита, т.е. ионообменный процесс.
Кроме внешней и внутренней диффузии, а также диффузионного переноса ионов водорода, на скорость разложения может оказывать решающее влияние и диффузия вытесняющего иона кислоты из объема раствора к зерну концентрата данбурита, окруженному неподвижной пленкой раствора.
С целью определения стадии лимитирующей скорость процесса разложения, была проведена соответствующая обработка кинетических кривых, результаты которой приведены на рис. 2.
Доказательством того, что лимитирующей стадией процесса разложения является внешняя диффузия (поверхность соприкосновения фаз, концентрация кислоты и соотношение Ж:Т), служит прямолинейная зависимость в координатах LgKср – 1/Т и их взаимодействие контролируется именно диффузионным процессом как функция от времени.
Зависимость LgКср от обратного значения абсолютной температуры для процесса сернокислотного разложения подчиняется корреляционному уравнению LgKср = -1420,1*(1/Т) + 2,7219 при значении коэффициента корреляции R2= 0,9869 (рис. 2.а.). Как видно, полученные экспериментальные точки при различных температурах удовлетворительно укладываются на прямую линию Аррениуса, по наклону которой вычислена величина кажущейся энергии активации для процесса сернокислотного разложения концентрата данбурита.
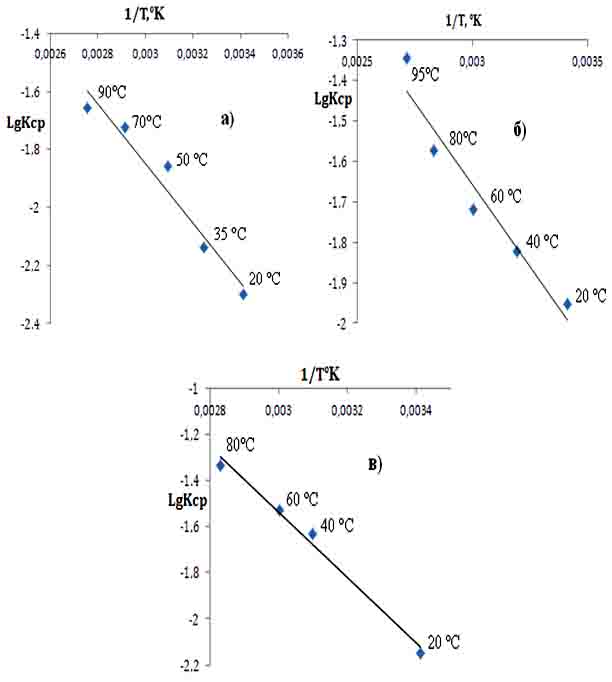
Рис. 2. Зависимость LgKср – 1/Т для процесса выщелачивания концентрата данбурита серной (а), азотой (б) и соляной (в) кислотами.
Рассчитано также значение энергии активации для процесса азотнокислотного разложения данбуритового концентрата и установлено, что зависимость LgKср – 1/Т подчиняется корреляционному уравнению LgKср = -813,89*(1/Т) +0,7855 при значении коэффициента корреляции R² = 0,9333 (рис. 2.б.). Экспериментальные точки, полученные при температурах от 20 до 95°С удовлетворительно укладываются на прямую Аррениуса. Для определения энергии активации строили график зависимости lgk от 1/Т, при этом получена прямая линия, по наклону которой вычислена величина кажущейся энергии активации процесса азотнокислотного разложения.
Данные эксперимента процесса солянокислотного разложения данбуритового концентрата при температурах 20-80°С и зависимость LgKср – 1/Т подчиняется корреляционному уравнению LgKср = -1025,4*(1/Т) +1,2285 при значении коэффициента корреляции R² = 0,9498.
Изменение константы скорости разложения концентрата данбурита соляной кислотой от температуры процесса подчиняется закону Аррениуса, что подтверждается прямолинейной зависимостью lgК от 1/Т, по наклону которой вычислена величина кажущейся энергии активации (рис. 2.в.).
Численные
значения величины энергии активации для процессов выщелачивания концентрата данбурита
равны (кДж/моль): для![]() -16.68, для
-16.68, для ![]() - 14,83 и для
- 14,83 и для ![]() - 29,44, соответственно.
- 29,44, соответственно.
Таким образом, скорость разложения концентрата данбурита минеральными кислотами при всех изученных температурах осуществляется в смешанно-диффузионном режиме близко к кинетической, т.е. разложения контролируется одновременно диффузией ионов водорода в растворе и диффузией в зерне (зависить от размера частиц) концентрата данбурита.
Литература
1. Рузиев Д.Р., Азизов Б.С., Сафиев Х.С., Раджабов Ф. Магнитная сепарация углерод-криолитного отсева отходов производства алюминия // Доклады АН РТ – Душанбе. - 1996. - Т.39. – № 1-2. -С.47-51.
2. Рузиев Д.Р., Азизов Б.С., Сафиев Х.С., Раджабов Ф. Сушка криолит-глиноземсодержащего концентрата, полученного из отходов алюминиевого производства // Доклады АН РТ – Душанбе. - 1996.-Т.39. - №11-12. -С.58-63.
3. Зинченко З.А., Соколов Е.С., Рузиев Д.Р., Азизов Б.С, Раджабов Ф. Получение криолит-глиноземной смеси из углерод-, фторсодержащих отходов производства алюминия. Деп. В НПИ Центре. 1998 г. .№48(1192). – Душанбе. -8с.
4. Зинченко З.А., Соколов Е.С., Рузиев Д.Р., Азизов Б.С. Получение криолит-глиноземной смеси из отсева свалки твердых отходов (СТО) Деп. В НПИ Центре. 1998 г. .№49(1193). – Душанбе. -10с.
5. Алимарин М.П., Ромм М.И. Методика определения бора в силикатных минералах и борных породах. – М.-Л.: Гостехиздат, 1932.
6. Эммануэль Н.М., Кнорре Д.Г. Курс химической кинетики. – М.: Высшая школа, 1974. - 400 с.
Поступила в редакцию 19.09.2012 г.