Изучение молочнокислых микроорганизмов, выделенных из кисломолочных продуктов Казахстана
Конарбаева Зулфия Кемелхановна,
докторант кафедры биотехнологии Южно-Казахстанского государственного университета им. М. Ауэзова, Республика Казахстан.
Выделение чистых культур молочнокислых бактерий включает ряд этапов: выбор источников, отбор образцов, посев на жидкую питательную среду для обогащения молочнокислой микрофлорой, посев на плотную среду для выделения чистой культуры, пересев чистой культуры (колоний) в стерильное молоко, исследование биологических свойств выделенных штаммов в целях их идентификации и определения производственной ценности. Для выделения молочнокислых бактерий из различных источников рекомендован ряд сред. Это жидкие и агаризованные среды, в их состав входят ингредиенты, богатые аминокислотами и витаминами, томатный сок, дрожжевой экстракт и автолизат, белковые гидролизаты [2].
Материалы и методы
Источниками выделения для мезофильных молочнокислых бактерий являются сырое молоко, производимые в южном регионе Республики Казахстан национальные кисломолочные продукты, в основном слабоскисшийся айран, курт, кумыс, кымыран, каймак, сузбе, а также приготовленные по разным рецептурам коже. Если культуру выделяют из кисломолочных продуктов, то одну каплю продукта вносят бактериологической петлей в стерильное молоко. Посевы термостатируют при 25-30°С до свертывания молока. При выделении мезофильных молочнокислых стрептококков из растительного сырья 1 г пробы растирают в стерильной ступке и готовят разведение 1:10 на физиологическом растворе.
Процесс выделения чистых культур термофильных бактерий аналогичен процессу выделения мезофильных молочнокислых стрептококков. В качестве накопительных культур использовали айран, катык, курт, сузбе и другие национальные продукты. При этом термофильные молочнокислые стрептококки и палочки культивируют при 40-43 °С, за исключением ацидофильной палочки, которую выращивают при 37 °С. После проверки сгустка на типичность органолептических свойств и микрофлоры полученную обогащенную культуру, выращенную на стерильном молоке, высевают на плотную питательную среду (агар с гидролизованным молоком). Посевы термостатируют в течение 48 ч.
Выделенные высокоактивные штаммы микроорганизмов позволят получить закваску с необходимыми пробиотическими свойствами. Предпочтение отдавали тем культурам, которые обладали достаточно высокой активностью сквашивания молока, значительной антагонистической активностью, устойчивостью к антибиотикам. Штаммы молочнокислых бактерий, выделенные из различных источников, микроскопировали и изучали их активность при свертывании молока и органолептические показатели. Для выделения чистой культуры в качестве твердой питательной среды использовали гидролизованное молоко с агаром и среду MRS.
Результаты исследований
В результате проделанной работы из различных национальных молочных продуктов были выделены 207 колоний, из которых в дальнейшем, использовались только 25 колоний, как наиболее часто встречающиеся, следовательно, более адаптированых к местным условиям.
По-видимому, использование молочной продукции южного региона оказало существенное вляние на оптимальный и предельный температурный рост. Среди исследуемых культур преобладают термолабильные и термофильные организмы (SSh-23, АТ-3, IT-2, ТК-23, ZT-27. KL-21, KuA-16, KuS-12).
Выраженная способность к продуцированию молочной кислоты является одним из наиболее известных биологических свойств молочнокислых бактерий, которая рассматривается в качестве одного из основного параметра, характеризующего их биохимическую и антагонистическую активность [1]. Это один из важных факторов антагонизма в отношении других видов микробов. Активность кислотообразования является нормируемым показателем специфической активности лактосодержащих пробиотиков и соответственно критерием отбора штаммов лактобактерий при разработке новых бактерийных препаратов [4].
Селекцию новых штаммов, в дальнейшем планируемые использовать как пробиотики, проводили по таким параметрам как продолжительность свертывания и кислотообразующая активность. Штаммы, титруемая кислотность которых колеблется в пределах 20-80°Т, считаются неактивными, а те у которых этот параметр свыше 120°Т высокоактивными [7].
Полученные в результате экспериментальных работ данные свидетельствуют о хорошей кислотообразующей способности у большинства исследуемых штаммов.
Несмотря на то, что именно воздействие молочной кислоты рассматривают как выраженное бактерицидное свойство, однако, по мнению многих авторов полной аналогии между интенсивностью кислотообразования и антагонистической активностью молочнокислых бактерий не происходит [1; 5].
В таблице 1 представлены данные об основных культуральных и физиологических свойствах выделенных штаммов.
Таблица 1.
Основные культуральные и физиологические свойства выделенных штаммов.
|
№ п/п |
Условное обозначение штаммов |
Продолжительность свертывания при внесении 3 % закваски, час |
Кислотообразо-вание в молоке, оТ |
Температура роста, оС |
Рост в молоке при температуре, оС |
Рост в молоке после нагревания в течение 30 мин, оС |
||||
|
После 8 часов |
Предель- ная |
Опти- мальная |
Предел |
40 |
45 |
55 |
60 |
|||
|
1 |
KSh-12 |
4-5 |
75 |
120 |
28-32 |
10-42 |
+ |
- |
- |
- |
|
2 |
SSh-23 |
4-6 |
85 |
115 |
40-45 |
15-55 |
+ |
+ |
+ |
- |
|
3 |
Sha-2 |
4-5 |
80 |
110 |
28-32 |
10-39 |
- |
- |
- |
- |
|
4 |
Sl-12 |
6-8 |
80 |
110 |
28-30 |
10-32 |
- |
- |
- |
- |
|
5 |
Sh-4 |
4-6 |
75 |
115 |
28-30 |
12-32 |
- |
- |
- |
- |
|
6 |
IT-2 |
3,5-5 |
90 |
120 |
40-45 |
15-55 |
+ |
+ |
+ |
- |
|
7 |
Тр-2 |
4-5 |
100 |
300 |
37-38 |
20-55 |
+ |
+ |
+ |
- |
|
8 |
АТ-3 |
3,5-5 |
110 |
170 |
40-45 |
15-55 |
+ |
+ |
+ |
- |
|
9 |
ТК-23 |
3,5-5 |
120 |
190 |
40-42 |
15-60 |
+ |
+ |
+ |
+ |
|
10 |
ZT-27 |
4-5 |
120 |
180 |
40-45 |
20-55 |
+ |
+ |
+ |
- |
|
11 |
СС-2 |
4-5 |
90 |
120 |
28-32 |
10-39 |
+ |
- |
- |
- |
|
12 |
КК-31 |
3,5-5 |
80 |
120 |
40-45 |
15-55 |
+ |
+ |
+ |
- |
|
13 |
SSа-1 |
4-5 |
80 |
120 |
28-32 |
10-39 |
- |
- |
- |
- |
|
14 |
SPа-1 |
4-5 |
75 |
110 |
28-32 |
10-39 |
- |
- |
- |
- |
|
15 |
СPm-2 |
4-5 |
180 |
320 |
40-45 |
20-55 |
+ |
+ |
+ |
+ |
|
16 |
СPz-1 |
4,5-5,5 |
75 |
110 |
22-35 |
10-40 |
+ |
+ |
- |
- |
|
17 |
AL-32 |
4-5 |
120 |
180 |
37-38 |
20-55 |
+ |
+ |
+ |
- |
|
18 |
KL-21 |
4-5 |
120 |
200 |
40-45 |
15-55 |
+ |
+ |
+ |
- |
|
19 |
КА-5 |
4-5 |
75 |
110 |
28-34 |
10-45 |
+ |
- |
- |
- |
|
20 |
KuS-12 |
3,5-5 |
90 |
150 |
40-45 |
15-60 |
+ |
+ |
+ |
+ |
|
21 |
ZpА-22 |
4-5 |
100 |
140 |
28-32 |
10-45 |
+ |
- |
- |
- |
|
22 |
KuA-16 |
4-5 |
145 |
300 |
40-45 |
20-55 |
+ |
+ |
+ |
- |
|
23 |
KL-23 |
4-5 |
120 |
180 |
37-38 |
20-55 |
+ |
- |
- |
- |
|
24 |
К-1 |
4-5 |
80 |
120 |
28-32 |
10-39 |
- |
- |
- |
- |
|
25 |
К-3 |
5-5,5 |
75 |
100 |
28-34 |
10-39 |
+ |
+ |
+ |
- |
Устойчивость выделенных штаммов к желчи является косвенным показателем жизнеспособности клеток, которая возможно обеспечит их поступление в кишечную зону и реализацию пробиотических их свойств. Это связано с тем, что пробиотик, прежде чем достигнуть толстого кишечника, должен выжить при проходе через желудок. Неблагоприятное действие желудочного сока является основным барьером, который необходимо преодолеть выделенным и вносимым бактериям. Среди молочнокислых бактерий наиболее кислотоустойчивыми являются лактобактерии, которые обладают достаточной степенью резистентности к кислому содержимому желудка [3, 6]. Наибольшее содержание микроорганизмов наблюдается в толстой кишке. Здесь их концентрация достигает 1010-1011 и более на 1 г содержимого.
Нами были проведены эксперименты по определению устойчивости выделенных штаммов к соляной кислоте. В жидкую среду MRS, засеянную тестируемыми бактериями, вносили соляную кислоту, устанавливая значения рН от 4,5 до 6,5. Установлено, что значительное количество выделенных культур обладают достаточной устойчивостью к кислой среде. Лишь отдельные культуры, такие как СС-2, СPz-1 показали низкий рост при внесении соляной кислоты.
Устойчивость к низким значениям рН – одна из основных характеристик для пробиотических бактерий [10]. Бактерии вместе с пищей попадают в неблагоприятные для них условия желудка. Хотя подавляющие условия желудка вызваны pH близкой к 1,5, в большинстве случаев, в лабораторных условиях in vitro выбирают обычно pH 3.
Рисунок 1 показывает способность молочнокислых бактерий выживать в кислой среде (pH 3).
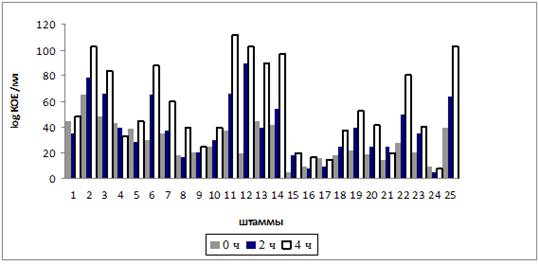
Рис. 1. Способность молочнокислых бактерий выживать в кислой среде (pH 3).
Следующие штаммы SSh-23, Sha-2, IT-2, CC-2, KK-31, SSa-1, KuA-16 и K-3 показывают значительную устойчивость к низким рН. Данные штаммы не только устойчивы к кислой среде, но и способны к дальнейшему росту и размножению. Некоторые штаммы обладают более низкой способностью к развитию в кислой среде, однако необходимо отметить, что выращенные культуры, в целом, показывают хорошую устойчивость к низким рН.
Желудок и верхняя часть тонкой кишки почти свободны от бактерий, так как бактерии, поступившие извне с пищей, почти полностью уничтожаются соляной кислотой, содержащейся в желудочном соке. Одним из основных требований к современному пробиотическому препарату, является его устойчивость к действию желчи и желудочного сока.
Желчь выделяется в тонкой кишке и присутствие желчи создает неблагоприятные условия для большинства бактерий. Желчные соли уменьшают выживание бактерий, поскольку взаимодействуют с клеточной мембраной бактерий, в которой основные компоненты – липиды и жирные кислоты. Блокирующее воздействие отрицательно влияет на проницаемость клетки [8].
Суточная культура была внесена нами в среду бульона MRS, содержащую концентрат желчи 0,3% и 0,5%. Бактериальный рост анализировался путем подсчета жизнеспособных колоний после 0, 2 и 4 часа культивирования и при дальнейшем инокулировании в агаризованную среду при 37oC в течении 48 часов. 0,1 мл раствора, который содержал определенный, ранее выделенный штамм был добавлен в 10 мл бульона MRS, затем был инокулирован 24 часа при 37oC.
Рисунок 2 показывает выживание молочнокислых бактерий в среде содержащей 0,3 % и 0,5% желчных солей.
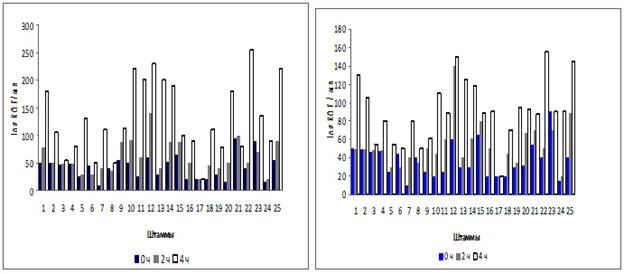
а) б)
Рис. 2. Выживание молочнокислых бактерий в среде, содержащей а) 0,3% желчных солей, б) 0,5% желчных солей.
Наиболее устойчивыми к кислой среде оказались штаммы KSh-12, ZT-27, KK-31, Spa-1, SSa-1, KuA-16, K-3.
Средняя концентрация желчи в кишечнике - 0,3% и время нахождения пищи в тонкой кишке приблизительно 4 часа [9]. Проведенные опыты показывают значительную устойчивость выделенных культур к действию желчи.
В ходе изучения морфологических признаков мы убедились, что клетки всех исследуемых культур были неподвижны, не содержали спор, окрашивались положительно по Граму и были каталазонегативны. По этим признакам они являются типичными представителями семейства молочнокислых бактерий.
Приведенные морфологические и культуральные свойства молочнокислых бактерий использовали для их идентификации. Способность молочнокислых бактерий к сбраживанию углеводов сильно варьирует при изменении условий культивирования, но данный признак можно рассматривать как вспомогательный при их идентификации, поэтому у выделенных микроорганизмов была изучена и сбраживаемая углеводная способность.
В соответствии с определителем Bergey выделенные молочнокислые бактерии были отнесены к роду Streptococcus и Lactobacterium. Изученные культуральные и морфологические признаки клеток дали возможность определить видовую принадлежность исследуемых штаммов: из 25 штаммов 5 штаммов являются представителями Lac lactis; к S. thermophilus относятся 6 штаммов; к L. аcidophilus относятся 5 представителей; к представителям Lbm. bulgaricus мы отнесли 5 выделенных штаммов. Две культуры были отнесены к Lbm. рlantarum и два выделенных штамма к Lbm. Casei.
Литература
1. Глушанова Н.А., Блинова А.И., Бахаева В.В. Об антагонизме пробиотических лактобацилл // Эпидемиология и инфекционные болезни. – 2004. - № 6. – С. 37-39.
2. Гудкова М.Я. Технология бифидосодержащих молочных продуктов: Автореф. дис. канд. техн. наук. - Л., 2006, 16 с.
3. Ленцнер А.А., Микельсаар М.Э., Воронина М.Н. О количественном составе микрофлоры кала здоровых взрослых при обычном питании // 16 научная сессия ин-та питания АМН СССР: Тез. докл. – М., 1966. – С. 153-154.
4. Лиходед В.Г., Бондаренко В.М. Антиэндотоксиновый иммунитет в регуляции численности эшерихиозной микрофлоры кишечника. Медицина, 2007. – 216 с.
5. Тюрин М.В. Антибиотикорезистентность и антагонистическая активность лактобацилл: дис. … канд. мед. наук. - М., 1990. – 146 с.
6. Чернякова В.И., Смирнова Т.В. Влияние желчи на интестинальные аэробные бактерии // Врач. дело. – 1978. - № 10. – С. 87-91.
7. Эйсфельд Д.А. Биологическая характеристика производственных штаммов лактобактерий: дисс…. канд. биол. наук. – 2002. – 129 с.
8. Gilliland, S.E, Staley, T.E., and Bush, L.J. 1984. Importance of bile tolerance of Lactobacillus acidophilus used as dietary adjunct. J. Dairy Sci. 67: 3045-3051.
9. Prasad, R.; Sankhyan, S. K.; Karim, S. A., 1998. Growth performance of broiler rabbits fed on diets containing various types of protein supplements. Indian J. Anim. Prod. Manage., 14 (4): 227-230.
10. Saarela M., Mogensen G., Fonden R., Matto J. and Matilla S. T. 2000. Probiotic bacteria: Safety, functional and technological properties. Journal of Biotechnology 84: 197-215.
Поступила в редакцию 20.08.2014 г.