Состав и характер включений фосфорных соединений редкоземельных элементов в структуру фосфогипса
Зык Наталья Владимировна,
кандидат химических наук, доцент кафедры Белорусского национального технического университета,
Шункевич Виолета Олеговна,
старший преподаватель кафедры Белорусского национального университета,
|
Зык Виктор Викторович |
кандидат химических наук,
Карпунин Александр Витальевич,
инженер кафедры общей и физической химии Санкт-Петербургского минерально-сырьевого «Горного» университета.
Апатитовые руды Кольского полуострова, как известно, представлены главным образом кальцийфторапатитом 3Ca3(PO4)2 CaF2, а также в небольших количествах – гидроксилапатитом 3Ca3(PO4)2 Са(ОН)2 и другими соединениями изоморфного замещения. Из минералов-примесей в апатитовой руде содержатся: нефелин (Na,K)AlSiO4 SiO2; эгирин NaFe(SiO3), титаномагнетит Fe3O4 FeTiO2 TiO2, ильменит FeTiO3, сфен CaTiSiO5, полевые шпаты и др. [1]. Установлено [2], что для апатитов характерно изоморфное замещение ионов кальция, образующих решетку кристаллов Са5F(РО4)3, ионами редкоземельных элементов (РЗЭ), имеющими близкие кристаллохимические радиусы. Сложность химического состава апатитового концентрата и высокая кислотность в экстракторах при разложении фосфатов создают благоприятные условия для замещения ионов друг другом в процессе образования кристаллических осадков при преимущественном образовании сульфата кальция.
Учитывая сложность химического состава апатитового концентрата и разнообразие химических процессов, протекающих при его взаимодействии со смесью фосфорной и серной кислот, можно ожидать, что при кристаллизации сульфата кальция в фосфогипсе в составе его структурных элементов могут быть соосаждены и адсорбированы самые различные компоненты, содержащиеся в сернокислотной пульпе экстрактора.
До настоящего времени практически не изучен механизм включения соединений РЗЭ в структуру фосфогипса, поэтому целью настоящей работы было установление состава и распределения в нем соединений РЗЭ.
Методом масс-спектрометрии было установлено, что для апатита характерно следующее соотношение оксидов РЗЭ, (мас. %): La–27; Ce–45; Pr–5,0; Nd–14,5; Sm–1,5; Eu–0,55; Gd–1,0; Tb–0,15; Dy–1,1; Ho–0,1; Er–0,1; Yb–0,2; Y–3,0, причем в апатите содержатся в основном легкие элементы РЗЭ (La-Nd). Именно поэтому в качестве объектов исследования нами были выбраны соединения церия, лантана и неодима (главным образом фосфаты, фториды и системы на их основе).
Для определения растворимости соединений РЗЭ в экстракционной фосфорной кислоте в процессе ее производства, а также для определения поведения соединений РЗЭ в фосфогипсе, нами исследована растворимость в системах LnF3 - H3PO4 - H2O и LnPO4 - H3PO4 - H2O при 70°С, содержащих 3 мас. % H2SO4. Выбор указанных составов был обусловлен возможностью образования в них малорастворимых фторидов и фосфатов РЗЭ. С этой целью фториды или фосфаты лантана, церия или неодима марки «х.ч.». в количестве 3-5 г помещали в полиэтиленовый сосуд на 100 мл и туда же вносили серную и фосфорную кислоты заданных концентраций. Реакционный сосуд герметизировали посредством гидравлического затвора на горлышке сосуда, который был заполнен фторидным маслом. Содержимое сосуда перемешивали пропеллерной мешалкой из фторопласта-4 при постоянной температуре в течение 6 ч. и по просветлении жидкой фазы измеряли ее показатель преломления и далее определяли химический состав. Достижение равновесия в исследуемых системах контролировали по неизменности показателя преломления.
В изученных системах была установлена низкая растворимость фторидов и фосфатов исследуемых РЗЭ во всем исследуемом диапазоне концентраций фосфорной кислоты (25-32 мас.% Р2О5). При этом отмечено уменьшение растворимости фторидов и фосфатов РЗЭ по мере понижения концентрации кислоты, а также наименьшая растворимость соединений лантана, в изученном диапазоне концентрации H3РО4 (таблица 1).
Таблица 1.
Растворимость соединений РЗЭ в H3PO4 при 70˚С.
|
Концентрация H3PO4, мас. % |
Растворимость, г/л |
|||||
|
NdF3 |
CeF3 |
LaF3 |
NdPO4 |
CePO4 |
LaPO4 |
|
|
34,5 |
0,27 |
0,12 |
0,057 |
0,49 |
0,36 |
0,27 |
|
37,3 |
0,29 |
0,13 |
0,063 |
0,54 |
0,42 |
0,29 |
|
40,1 |
0,31 |
0,14 |
0,071 |
0,61 |
0,46 |
0,32 |
|
42,8 |
0,32 |
0,16 |
0,076 |
0,67 |
0,51 |
0,36 |
|
45,5 |
0,33 |
0,16 |
0,082 |
0,75 |
0,58 |
0,40 |
|
48,3 |
0,33 |
0,17 |
0,092 |
0,83 |
0,62 |
0,46 |
Полученные экспериментальные значения равновесных концентраций основных составляющих компонентов в исследуемых солевых системах позволили рассчитать константы равновесий процессов растворения в них фторидов и фосфатов РЗЭ. Результаты исследования процессов осаждения фосфатов и фторидов РЗЭ в указанных системах показывают, что их совместное осаждение проходит во всем изученном интервале концентраций Н3PO4. Установлено, что по мере увеличения содержания РЗЭ происходит образование преимущественно осадка LnF3, а затем, когда равновесная концентрация лантаноидов повысится до такой степени, то уже при которой происходит достигаться равновесие растворимости LnPO4, и в результате начинается совместное осаждение двух соединений (LnF3 и LnPO4). Нами первоначально было исследовано осаждение соединений РЗЭ в модельной системе, исключающей наличие малорастворимой твердой фазы, а также при неизменной концентрации в ней основных компонентов (Ln, F, PO4), что соответствовало условиям производства экстракционной фосфорной кислоты.
Установлено, что содержание указанных компонентов в жидкой фазе реальных систем, образующихся в условиях разложения апатитового концентрата серной кислотой, практически не отличается от модельного. По данным рентгенофазового и дериватографического анализов синтезированные фосфаты и фториды РЗЭ образуют аморфную фазу, содержащую до 2 моль молекул воды. Эти результаты дают основание полагать наличие в осадке, полученном из модельного раствора, гидратированных фосфатов и фторидов лантаноидов.
С целью установления механизма включения лантаноидов в состав фосфогипса нами проведен рентгенофазовый анализ систем LaPO4 2H2O–CaSO4 2H2O, LaF3–CaSO4 2H2O. Изучение сокристаллизации соединений РЗЭ с CaSO4 2H2O проводили следующим образом. Исследуемые образцы были получены в результате совместного осаждения соответствующих количеств сульфата кальция, фосфатов или фторидов лантана из 1 н. базовых нитратных растворов Ca(NO3)2, La(NO3)3 марки «х.ч.» при добавлении расчетных количеств серной, фосфорной и фтористоводородной кислот. Параллельно проводили осаждение из фосфорнокислых буферных растворов, содержащих 25-35 мас.% P2O5, т.е. в присутствии большого количества избытка P2O5, в указанные растворы вводили стехиометрические количества нитратов лантана и кальция. Смешивание растворов и осаждение проводили в термостатированном сосуде с обратным холодильником, снабженным мешалкой в течение 2-4 ч (t=70ºС). Осадки промывали горячей водой и спиртом до полного удаления следов фосфорной кислоты и воды. Фазовый состав и параметры элементарных ячеек получаемых осадков контролировали рентгенографически. Дисперсность осадков определяли микроскопическим анализом. Исследование систем LaPO4 0.5H2O–CaSO4 2H2O, LaF3–CaSO4 2H2O проводили в широком концентрационном интервале исследуемых соединений с относительным шагом 10 мас. % в соответствующих системах. В результате исследования систем LaPO4 0.5H2O–CaSO4 2H2O, LaF3–CaSO4 2H2O нами не установлено химического взаимодействия или образования твердых растворов при кристаллизации осадков из фосфатных растворов. Линии рентгенограмм полученных образцов не претерпевают никаких смещений, что свидетельствует об отсутствии любых замещений ионов Ca2+ на La3+ в структуре дигидрата сульфата кальция.
Полученные нами результаты согласуются с результатами работы [3], в которой также не установлено химического взаимодействия и образования твердых растворов в системе NaCe(SO4)2 H2O–CaSO4 2H2O. Это позволяет сделать вывод о том, что в процессе производства экстракционной фосфорной кислоты РЗЭ не входят непосредственно в структуру дигидрата сульфата кальция в виде изоморфной примеси.
Содержание соединений РЗЭ в кристаллах CaSO4 2H2O в виде примеси количественно характеризуется коэффициентом захвата (К) [4], который был определен при микроскопическом исследовании фосфогипса по формуле
![]() ,
,
где x и y – содержание соединений РЗЭ и кристаллизанта (CaSO4 2H2O) в твердой фазе (мас.%), ср – концентрация РЗЭ в растворе (г/см3), ρ- плотность кристаллов (г/см3). Экспериментально установлено, что с увеличением среднего размера кристаллов CaSO4 2H2O L (мкм) возрастает коэффициент захвата РЗЭ (рис. 1). Из рисунка также видно, что между величинами L и K не существует простой зависимости. Это объясняется тем, что в условиях массовой кристаллизации сульфата кальция наблюдается увеличение коэффициента захвата по мере замедления роста кристаллов. Это увеличение можно в количественном отношении интерпретировать, приняв, что каждый слой кристаллизанта (CaSO4 2H2O), нарастающий на гранях кристаллов, накапливает лантаноиды с характеристической скоростью.
Характер включения соединений РЗЭ в структуру фосфогипса удалось определить при изучении внутренней морфологии и состава кристаллов. Методом электронной микроскопии исследован шлиф кристалла фосфогипса с относительно высоким содержанием РЗЭ (рис. 2). Исследуемый кристалл размером 150х300 мкм имел типичный вид и структуру для данных условий кристаллизации фосфогипса. На рисунке отчетливо наблюдается зональное распределения соединений РЗЭ в пределах кристалла.
При обработке результатов количественного анализа по профилям вдоль и поперек различных граней кристалла (рис. 2) установлено, что основная часть соединений РЗЭ содержится на торцевых гранях, при этом соединения РЗЭ в фосфогипсе распределены неоднородно – максимальное их количество наблюдается в поверхностном слое кристалла сульфата кальция.
Таким образом, проведенные нами исследования позволили установить характер включения соединений РЗЭ в структуру фосфогипса, а также провести количественную оценку этого явления на основании результатов комплексного физико-химического исследования систем LnF3 - H3PO4 - H2O и LnPO4 - H3PO4 - H2O.
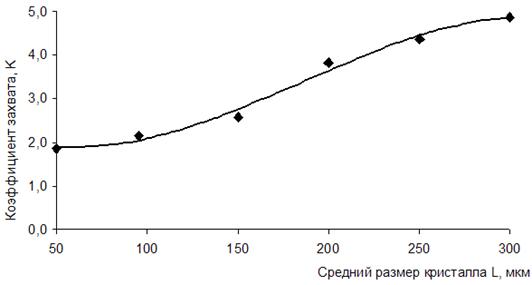
Рис. 1. Взаимосвязь коэффициента захвата РЗЭ (К) со средним размером кристалла CaSO4 2H2O (L).
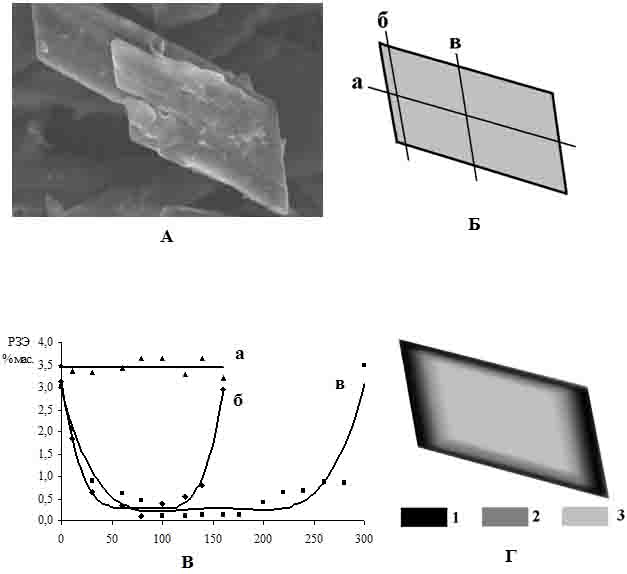
Рис. 2. Распределение соединений РЗЭ в шлифе кристалла фосфогипса. А – изображение сканированного кристалла (150х300 мкм); Б – схема профилей (а–в) в кристалле CaSO4 2H2O; В – концентрационные кривые РЗЭ по профилям (сумма РЗЭ); Г – схема распределения РЗЭ в кристалле (1 – до 5 мас.% РЗЭ, 2 – 1-3, 3 – менее 1 мас.% РЗЭ).
Резюме
Проведены исследования по установлению характера включений соединений РЗЭ в структуру фосфогипса, а также проведена количественная оценка этого явления на основании результатов комплексного физико-химического исследования систем LnF3-H3PO4-H2O и LnPO4-H3PO4-H2O.
Литература
1. Гольдинов А.Л.,Копылев Б.А.,Абрамов О.Б.,Дмитриевский Б.А. Комплексная азотнокислотная переработка фосфатного сырья. Л.: Химия, 1982, С.4.
2. Ферсман А.Е. Апатит, его месторождения, геохимия, запасы и экономика. Хибинские апатиты. Т.3. Л.: ОГИЗ, 1931.
3. Бушуев Н. Н.,Набиев А. Г., Петропавловский И. А. // Журн. прикл. химии. 1988. №10. С.2153-2158.
4. Мелихов И. В. Захват примеси при росте кристаллов из раствора // Рост кристаллов. т. IX. М., 1972. С. 302.
Поступила в редакцию 06.11.2015 г.