Основные способы получения нитрита натрия
Кодиров Муробек Мухиддин угли,
студент Ташкентского химико-технологического института.
Основные способы получения нитрита натрия. Представляет интерес разработка новых способов производства нитрата натрия, не требующих затраты щелочей. К таким способам относится получение нитрата натрия из NaCl и оксидов азота, а так же метод катионного обмена
These important chemical products include nitrite, nitrate, sodium and calcium, the demand for which is growing due to the development of the national economy, consuming nitrite - nitrate, sodium and calcium.
Химическая промышленность является базовой отраслью, которая находится в тесной взаимосвязи со всеми отраслями экономики, играет ключевую роль в агрохимическом комплексе. Производства отрасли должны быть основаны на высоких технологиях, а выпускаемая продукция по номенклатуре должна соответствовать мировым стандартам. Поэтому развитие химической промышленности является приоритетной задачей современного развития экономики Республики Узбекистан [1].
Одним из главных направлений экономического развития Узбекистана является освоение природных ресурсов, их комплексное использование и создание конкурентоспособных, импорто-заменяющих продуктов на базе местных сырьевых ресурсов.
К таким важным химическим продуктам относятся нитриты, нитраты натрия и кальция, потребность в которых неуклонно растёт в связи с развитием отраслей народного хозяйства, потребляющих нитрит - нитратные соли натрия и кальция.
Основные потребители нитрит – нитратных солей натрия и кальция- станко-машиностроительная, металлургическая, бумажная, резиновая, текстильная, фармацевтическая, пищевая промышленность, строительная индустрия, медицина и сельское хозяйство.
Из-за отсутствия собственного производства нитрит - нитратных солей натрия и кальция Узбекистан вынужден покупать их из-за рубежа (особенно нитритные соли). Годовая потребность Республики в нитрите натрия (только в пищевой промышленности) составляет свыше 5 тыс.т, при стоимость его на мировом рынке от 517,40 до 663,93 долларов США за тонну, а нитрита кальция - более 30 тыс.т. в год.
Представляет интерес разработка новых способов производства нитрата натрия, не требующих затраты щелочей. К таким способам относится получение нитрита натрия из NaCl и оксидов азота, а так же метод катионного обмена.
Процесс получения нитрата натрия методом катионного обмена состоит в основном из трёх стадий:
1. Получение раствора Cа(NO2)2.
2. Катионный обмен и регенерация (обмен ионов Са2+ на ионы Na+).
3. Выпаривание раствора NaNO2, кристаллизация соли, центрифугирование, сушка и упаковка.
Реакции, протекающие в первых двух стадиях процесса, могут быть схематически выражены следующими уравнениями:
![]() Ca(NO3)2 + (катионит) Na2 2NaNO2
+ (катионит) Cа
Ca(NO3)2 + (катионит) Na2 2NaNO2
+ (катионит) Cа
![]() (катионит) Cа + 2NaCl (катионит) Na2
+CaCl2
(катионит) Cа + 2NaCl (катионит) Na2
+CaCl2
При этом происходит непрерывное чередование процессов производства нитрата кальция и регенерация катионита кальция растворами хлористого натрия.
Промежуточными стадиями процесса являются: промывка водой катионита, выпарка и кристаллизация конвертированных растворов.
Описываемый метод нашёл промышленное применение в Норвегии.
Растворы нитрита кальция пропускают через ряд катионообменников, в которые загружен цеолит (природный минерал типа полевого шпата). Для регенерации цеолита используют морскую воду. Образующийся раствор нитрата натрия концентрируют выпариванием и далее кристаллизуют соль с последующей перекристаллизацией (для получения более чистого продукта). Готовый продукт можно использовать и в качестве удобрения.
В последующие годы были разработаны другие способы производства нитрита натрия [3-4].
В способе [4] сульфат натрия растворяют в 60%-ной азотной кислоте. После охлаждения раствора до 200С из него выпадают кристаллы нитрата натрия, которые легко отфильтровывают. После промывки и сушки кристаллов получают нитрит натрия. Образующийся маточный раствор, содержащий в основном серную кислоту, направляется на производство сложных удобрений.
Предлагается получение нитрита натрия разложением хлорида натрия азотной кислотой до содержания азотной кислоты 62-64% и охлаждением до температуры ниже 300С с последующим отделением нитрита натрия, а образовавшиеся маточные растворы концентрируют до содержания азотной кислоты выше 80% с последующим выделением нитрита натрия.
Технологических процессов получения нитрита и нитрата натрия необходимо изучение плотности и вязкости их растворов.
В связи с этим из продуктов конверсии сульфата натрия нитритом и нитратом кальция были подготовлены водные растворы нитрита и нитрата натрия с концентрацией 20, 30 и 40%. Концентрации указанных растворов брались в переделах близкими к производственным условиям.
Определение плотности раствора при 20, 40 600С проводили по общеприятной методике с помощью ареометра.
На рис. 1 и табл. 1 представлены экспериментальные данные по определению плотности водных растворов нитрита и нитрата натрия в зависимости от концентрации и температуры.
Результаты экспериментов показали, что с увеличением концентрации растворов нитрита и нитрата натрия значение плотности повышается. С увеличением температуры, наоборот, наблюдается уменьшение плотности растворов. При температуре 200С плотность растворов нитрата натрия с концентрацией 20, 30 и 40% составляет соответственно 1144,5, 1186,3 и 1256,1 кг/м3, т.е. увеличение плотности относительно 20% - ной концентрации составляет 4% и 10% соответственно для 30 и 40% -ной концентрации растворов. При температуре 400С значения плотности для исследуемых концентрации растворов нитрата натрия составили соответственно 1124,2; 1167,9 и 1237,7 кг/м3. Увеличение плотности относительно 20% ной концентрации составляет соответственно 3,7 и 92%.
Для температуры 600С плотность растворов имела значения 1116,1; 1149,6 и 1229,5 кг/м3. Увеличение плотности относительно 20%-ной концентрации нитрата натрия составило соответственно 3,0 и 9,3%.
Таким образом для 30 и 40% -ных растворов относительно 20%-ного увеличения плотности в интервале 20-600С происходят примерно с одинаковой интенсивностью и для 30% - ного раствора составляет 2,4 – 5,0%, а для 40%-ного раствора - 8,0 – 9,3%
Таблица 1.
Значение плотности растворов нитрата натрия в зависимости от температуры и концентрации.
|
Концентрация растворов нитрата натрия % |
Плотность растворов (кг/м3) при температуре, 0С |
||
|
20 |
40 |
60 |
|
|
20 |
1144,5 |
1124,2 |
1116,1 |
|
30 |
1186,3 |
1167,9 |
1149,6 |
|
40 |
1256,1 |
1237,7 |
1229,5 |
Зависимость плотности растворов нитрита натрия от температуры и концентрации представляет аналогичный характер. С увеличением концентрации NaNO2 от 20 до 30 и от 30 до 40% плотность растворов при 200С повышается соответственно но 3,65 и 9,75%. При 40 и 600С повышение плотности 30 и 40% - ных растворов NaNO2 по сравнению с 20% - ным раствором составляет соответственно 3,9 – 10,1 и 3,0 – 10,2%.
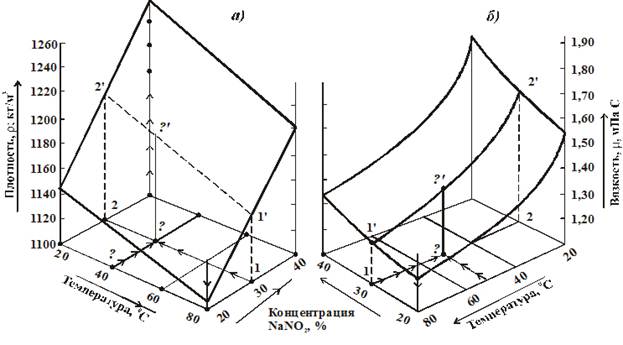
Рис. 1. Зависимость плотности (а) и вязкости (б) растворов нитрита натрия от температуры и ее концентрации.
Объемное графическое изображение результатов экспериментов (рис. 1.) позволяет достаточно точно и быстро определить (входные и выходные параметры) ρ и η растворов во всех диапазонах изученных концентрации и температур путем графической интерпретации.
Таким образом часть нитрата натрия в виде суспензии, полученной при концентрировании азотной кислоты, смешивают с маточными растворами, образовавшимся после отделения нитрита натрия перед их концентрированием.
Литература
1. Аналитический контроль производства азотной промышленности. Контроль производства натриевой селитры и нитрата натрия, М.,ГНТИ хим.литературы, - 1968, - №9, - 80 с.
2. Абуталыбов М.Г. Повторное использование кальция в растительном организме // Доклады АН – 1955.-т.105, -N5. –1042-1044 с.
3. Азимов Р.А. Физиологическая роль кальция в солеустойчивости хлопчатника – Тошкент: Наука, - 1973-184с.
4. Атрошенко В.И. и др. Технология связанного азота. Киев. «Выш.школа».-1985.-327с.
5. Атрощенко В.И., Каргин С.И. Технология азотной кислоты. М.: Химия,-1070.-494 с.
Поступила в редакцию 13.07.2016 г.