Исследование сорбции кобальта(II) новым сорбентом на основе сополимера малеинового ангидрида
Гаджиева Севиндж Рафиг кызы,
доктор химических наук, профессор,
Алиева Тарана Ибрагим кызы,
кандидат химических наук, доцент,
Джафарова Н. М.
Бакинский государственный университет.
Тяжелые металлы — это загрязняющие вещества, наблюдение за которыми обязательно во всех средах. Одним из экологически значимых для организма тяжелых металлов является кобальт. Кобальт относится к группе микроэлементов, т.е. является жизненно необходимым для функционирования живых организмов. Вместе с тем при избыточном содержании, как и многие другие элементы или более сложные вещества, он становится токсичным и может привести к гибели.
Для выделения кобальта из природных и промышленных объектов путем концентрирования часто используют природные и синтетические сорбенты. В качестве синтетического сорбента для кобальта(II) в основном используют хелатообразующие сорбенты [1 — 4]. Эффективность, простота и селективность метода обеспечивают его широкое применение.
Получение новых сорбентов обладающих более высокими сорбционными свойствами по отношению к кобальту(II) всегда является актуальной проблемой. Сорбционные свойства полимерных сорбентов в основном зависят от природы, положения в звене, количества функционально аналитических групп, содержащихся в полимере, а также от физико-химических свойств полимерной матрицы [5].
Основная цель представленной работы — исследовать процесс сорбции кобальта(II) новым сорбентом на основе сополимера малеинового ангидрида со стиролом, модифицированного рубиноводородной кислотой. Сорбент синтезировали согласно методике, приведенной в работе [5], и высушивали при температуре 50 — 60 °С.
Исходный (1x10-2) раствор кобальта(II) готовили растворением точной навески Co(N03)4 x 6H20 (х.ч) в дистиллированной воде, а рабочие — разбавлением исходного раствора. Для создания необходимой кислотности использовали фиксанал НС1 (pH = 1-2) и аммиачно-ацетатные буферные растворы (pH = 3-11). Для создания постоянной ионной силы использовали КС1 (ч.д.а).
Кислотность раствора контролировали стеклянным электродом на иономере И-130 (Россия). Концентрацию растворов измеряли с помощью атомноабсорбционного анализатора марки ААS-1N (Польша).
Для определения микроколичеств ионов кобальта(II) были исследованы условия предварительного концентрирования Со2+ с использованием нового сорбента.
Результаты исследования показали, что, наибольшие степени извлечения кобальта достигаются при pH =6. Следует отметить, что низкая степень извлечения при pH жидкой фазы меньше 4 может быть связана с протонизацией функциональных групп сорбента и малой степенью набухае- мости полимерного сорбента. При более высоком pH жидкой фазы набухаемость его возрастает, и в результате создаются благоприятные условия для взаимодействия ионов металла с координационно-активными группами. В водных растворах с pH > 8 ионы Со2+ наряду с катионной формой могут присутствовать в виде гидроксокомплексов. При более высоких значениях pH ускоряется гидролиз и вследствие этого степень сорбции кобальта уменьшается.
Сорбционную способность сорбента исследовали в статических условиях. К 50 мг сорбента добавляли раствор кобальта и оставляли в буферной среде при pH =1-8. Затем смесь отфильтровывали. Количество оставшегося кобальта (Сост) в растворе находили по кривой оптической плотности и рассчитывали количество сорбированных ионов металла Е (табл. 1). Все дальнейшие исследования проводили при pH = 6.
Таблица 1.
Результаты исследования сорбции кобальта при Со = 58,9 мг/г и различных pH.
|
Показатель |
pH |
||||||||
|
Концентрация кобальта, мг/г: |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
|
|
|
|
|
|
|
|
||
|
Cост |
10,16 |
8,982 |
8,982 |
1,47 |
1,47 |
0,8835 |
5,007 |
8,69 |
|
|
Спог |
48,74 |
49,92 |
49,92 |
57,43 |
57,43 |
58,016 |
53,89 |
50,21 |
|
|
СЕ, мг/г |
19,50 |
19,97 |
119,97 |
22,97 |
22,97 |
23,21 |
21,56 |
20,08 |
|
|
R,% |
82,75 |
84,75 |
84,75 |
97,5 |
97,5 |
98,5 |
91,5 |
85,25 |
|
Примечание: Спог – поглощенная концентрация кобальта при сорбции, мг/г; Я- степень сорбции.
Чтобы определить оптимальные условия сорбции кобальта(II) полученным сорбентом было проведено исследование зависимости сорбционной емкости от начальной концентрации кобальта(II) Co. Результаты исследований приведены в табл. 2 и на рисунке 1.
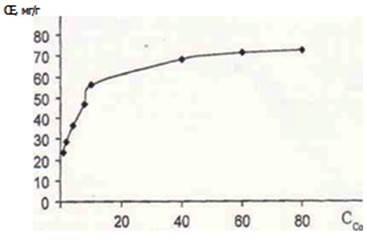
Рис. 1. Изотерма сорбции Со2+ полученным сорбентом (рН= 6).
Таблица 2.
Результаты исследования сорбции кобальта при pH = 6 и различной начальной концентрации, мг/г.
|
Показатель |
Со |
|||||||
|
58,9 |
117,8 |
235,6 |
471,2 |
589 |
2356 |
3534 |
4712 |
|
|
Концентрация кобальта, мг/г: |
||||||||
|
Cост |
0,88 |
46,56 |
145,01 |
353,7 |
448,8 |
2185,5 |
3356,4 |
4531,65 |
|
Спог |
58,01 |
71,24 |
90,51 |
117,5 |
140,1 |
170,75 |
177,6 |
180,31 |
|
СЕ, мг/г |
23,21 |
28,5 |
36,21 |
47,01 |
56,03 |
68,3 |
71,03 |
72,17 |
|
R,% |
98,5 |
60,45 |
38,48 |
24,94 |
23,77 |
7,25 |
5,02 |
3,83 |
При pH = 6 сорбционная емкость СЕ максимальна. С увеличением концентрации кобальта в растворе увеличивается количество сорбироваронного кобальта, а при концентрации равной 3534 мг/л становится максимальной. Исследования показали, что в оптимальных условиях концентрирования ионы кобальта количественно сорбируются (R > 95 %).
Увеличение ионной силы до 1,0 моль/л не оказывает заметного влияния на процесс сорбции. Дальнейшее увеличение ее приводит к значительному снижению степени сорбции. Это связано с тем, что с увеличением ионного окружения функциональных групп уменьшается возможность комплексообразования кобальта(II). Полная сорбция кобальта(II) происходит за 2 ч при статических условиях.
Эксперименты показали, что максимальная десорбция кобальта(II) достигается при использовании перхлоратной кислоты (табл. 3).
Таблица 3.
Влияние концентрации разных кислот на степень извлечения кобальта, %.
|
Кислота |
Концентрация, моль/л |
Степень десорбции,% |
|
HCI |
1,0 2,0 3,0 |
71 76 81 |
|
НСЮ4 |
1,0 2,0 3,0 |
92 95* 98 |
|
HN03 |
1,0 2,0 3,0 |
69 76 83 |
|
H2S04 |
1,0 2,0 3,0 |
75 84 89 |
Разработанная методика была опробована при определении кобальта(II) в морской воде. Кобальт попадает в морскую воду при выкачивании нефти и тем самым загрязняет ее.
Анализируемый раствор (1000 мл) заливают в колбу, добавлением HN03 (кон.) устанавливают pH = 6, вносят 100 мг сорбента и оставляют отстаиваться. Через 2 ч к отделенному сорбенту добавляют 10 мл ЗМ НСIO4, десорбируют поглощенный кобалът(II) и рассчитывают содержание кобальта(II) в воде, которое составляет 0,006 мг/л, что превышает допустимые нормы.
Предлагаемая новая комплексная экспрессная методика, включающая в себя предварительное концентрирование кобальта рассматриваемым сорбентом, позволяет количественно выделять кобальт из большого объема пробы со сложным фоновым составом и обеспечивает надежное правильное определение ее концентрации с достигаемой точностью.
Литература
1. Садцадзе К.М, Копылова-Валова В.Д. Комплексообразующие иониты. М.: Химия, 1980.
2. Цизин Г.И., Золотов Ю.А. Проточные сорбционно-спектроско- пические методы анализа // Журнал аналитической химии. 2002. Т. 57. №7., с.136-140.
3. Саввин С.Б., Дедкова В.П., Швоева О.П. Сорбционно-спектроскопические и тест-методы определения ионов металлов на твердой фазе ионообменных материалов // Успехи химии. 2000. Т. 69. № 3., с129-133.
4. Мясоедова Г.В., Саввин С.Б. Хелатообразующие сорбенты. М.; Наука, 1984.
5. Алиева Р.А., Чырагов Ф.М., Гамидов С.З. Сорбционное исследование меди (II) полимерным сорбентом // Химические проблемы. 2006. № 4. С.45-47.
Поступила в редакцию 21.11.2017 г.